近日👩🏼💼,我校生物與醫學工程學院史向陽教授團隊在癌症診療納米醫學方面取得系列重要研究進展,相關成果分別發表於國際知名意昂4《今日納米》(Nano Today)和《先進材料》(Advanced Materials)。該系列工作得到了國家自然科學基金委、國家自然科學基金國際(地區)合作與交流項目、上海市科委政府間國際合作項目及中央高校研究生創新基金等項目的資助🚗。
臨床腫瘤治療中👳🏻♀️,兼備無創性和全身抗腫瘤能力的化療仍是主要方法👨👩👧👧,但腫瘤部位復雜的生理和病理障礙嚴重製約著臨床化療效果。在開發新型智能診療納米平臺時👩🏻🦯➡️,需要考慮多種障礙,主要包括免疫抑製的腫瘤微環境(TME)、免疫清除、網狀內皮系統(RES)引起的滯留效應、高間質液壓力、血管滲漏和淋巴引流不良等。為了克服免疫和RES器官清除,由於癌細胞膜(CCM)上存在免疫片段、抗原和膜錨蛋白,多種CCM包裹的仿生納米平臺被賦予了免疫逃逸和同源腫瘤靶向能力。另外,探索可有效誘導腫瘤免疫原性的新化療靶點,激活免疫系統並逆轉TME的免疫抑製性💆🏽♂️,有望實現增強的治療效果。為了實現精準的成像診斷、有效的腫瘤給藥和降低全身毒副作用💬,設計TME(酸性pH、過量谷胱甘肽(GSH)等)刺激響應性釋放藥物的智能納米藥物尤為關鍵🧑🏼🔧。同時,考慮到對腫瘤的聯合治療可能會引起腫瘤細胞表面免疫檢查點分子表達增加📵,將聯合治療與免疫檢查點阻斷(ICB)療法結合將有望逆轉免疫抑製的TME並產生長期抗腫瘤免疫記憶效應💶。
相比傳統合成的納米藥物開發,微流控技術能夠通過在微米尺度空間操控微流體進行反應🤦🏽♀️,可以精確控製納米平臺的合成過程,包括成核🍾、生長和聚集。微流控作為一種很有前途的技術👊🏻,具有試劑損耗低、可控製備和一步合成等特點,在合成高質量納米平臺方面具有相當的優勢👱🏿♂️,能極大助力納米藥物的臨床轉化。史向陽教授團隊首先基於微流控技術開發了CCM包覆的負載順鉑的聚多巴胺超小氧化鐵納米團簇(FDPC NCs)用於腫瘤微環境刺激響應的動態磁共振成像導引的腫瘤聯合治療(圖1)⏏️。該研究設計的FDPC納米平臺的主要優勢在於以下幾個方面🔀:(1)與傳統濕化學方法製備的類似物相比,基於微流控的方法製備的FDPC納米平臺具有更好的均一性、膠體穩定性和TME刺激藥物釋放性能👨🏽🚀;(2)通過二硫鍵的斷裂消耗GSH和基於超小鐵介導的ROS生成,調控腫瘤微環境,降低癌細胞的抗氧化能力,促使癌細胞對藥物和ROS敏感,減少毒副作用🐘;(3)FDPC納米平臺具有良好的同源靶向性能👩🏼🌾、光熱性能和GSH響應的MR成像性能,可用於靶向腫瘤GSH響應的動態T2/T1 MR成像和聯合治療😑。本研究為高質量納米藥物的可控製備及腫瘤的精準診療提供了新的思路。該成果以《增強腫瘤微環境調控型智能超小氧化鐵納米團簇的微流控合成及其動態磁共振成像引導的腫瘤光熱/化學/化學動力學治療》(Microfluidic synthesis of intelligent nanoclusters of ultrasmall iron oxide nanoparticles with improved tumor microenvironment regulation for dynamic MR imaging-guided tumor photothermo-chemo-chemodynamic therapy)為題,發表於國際知名意昂4《今日納米》(Nano Today)(https://doi.org/10.1016/j.nantod.2022.101615)⏲,生物與醫學工程學院博士研究生楊瑞為第一作者,史向陽教授為通訊作者📓。
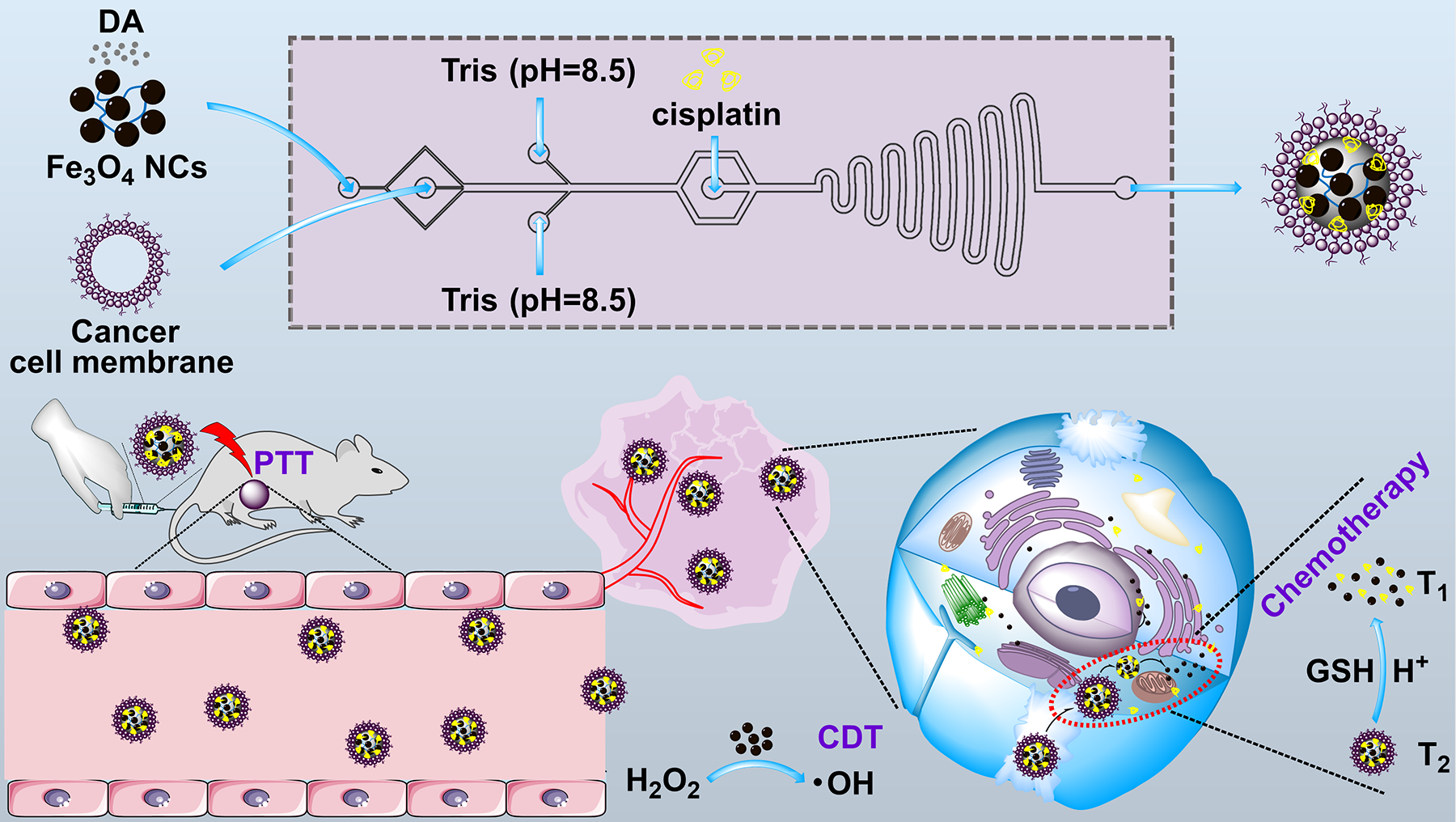
圖1. FDPC的微流控製備及其用於動態T2/T1 MR成像引導的腫瘤光熱-化學-化學動力學三模態聯合治療的示意圖。
其次,為了進一步探索聯合治療與ICB的聯合優勢,史向陽教授團隊製備了細胞膜仿生、負載了1G3-Cu和內質網應激藥物豐加黴素(Toy)的還原響應型聚合物納米膠束用於化療增強的腫瘤免疫治療(圖2)。研究團隊首先利用含有二硫鍵的兩親性聚合物(PEG-SS-PCL)形成膠束,將1G3-Cu包封在其疏水空腔,並通過氫鍵作用負載Toy,最後在其表面包覆B16黑色素瘤細胞膜(CM)🚒,得到還原響應的聚合物納米顆粒(GCT@CM NPs)。該研究設計的GCT@CM NPs納米平臺具有多個優勢:(1)構建的NPs聯合CM顯著提高了1G3-Cu和Toy的生物利用度並降低了它們的副作用,使1G3-Cu和Toy在TME中響應性釋放🫢,從而通過線粒體和內質網應激兩個途徑誘導腫瘤細胞凋亡🧑🧑🧒;(2)Toy介導的內質網應激放大可以與1G3-Cu誘導的線粒體功能障礙協同作用,增強ICD效應,熟化DCs並招募免疫細胞進入TME🏡;(3)GCT@CM NPs與Anti-PD-L1聯合使用🦹🏽♀️,可產生長期免疫應答,抑製腫瘤的復發和轉移🙍🏻♂️。本研究製備的GCT@CM NPs為整合不同的治療靶點以實現化療增強的免疫治療提供了新的思路。該研究成果以《仿生聚合物納米顆粒通過放大內質網應激和誘導線粒體功能障礙的化療增強腫瘤免疫治療》(Biomimetic Polymeric Nanoparticle-Mediated Chemotherapy Potentiates Enhanced Tumor Immunotherapy via Amplification of Endoplasmic Reticulum Stress and Mitochondrial Dysfunction)為題,在線發表於國際知名意昂4《先進材料》(Advanced Materials)(https://doi.org/10.1002/adma.202206861)。生物與醫學工程學院博士生郭雲琦和範鈺為共同第一作者➔,史向陽教授與沈明武教授為共同通訊作者🙋👨🏻🚀。
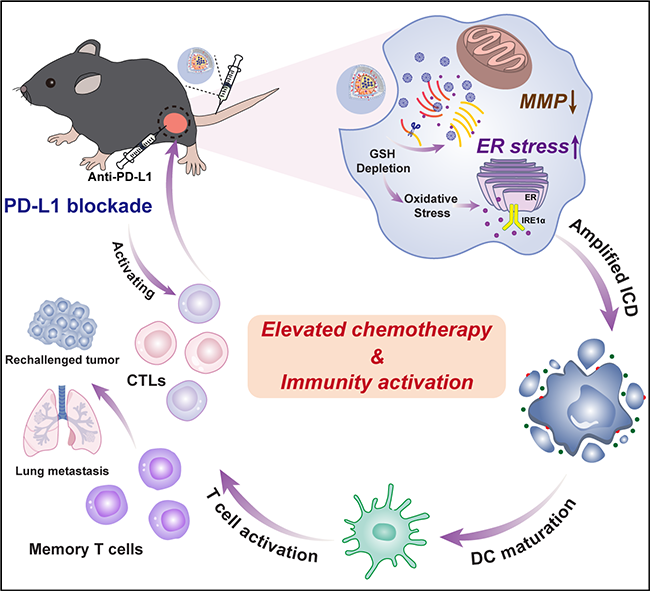
圖2. GCT@CM NPs的應用示意圖🚽。
據了解🐢,我校生物與醫學工程學院自成立以來,積極推進有組織科研,在健康中國戰略背景下,圍繞上海發展生物醫藥等三大先導產業🦻🧜🏼,積極布局生物材料與醫療器械、重大疾病診療與疫情防護🔑、人工智能與智慧醫療💢、合成生物學等學科方向和研究領域,通過全面加強學院創新機製和創新團隊建設🧛🏿♀️,以更高質量🫡、更大貢獻服務國家戰略需求🙎🏻♀️。
